

Seguimiento clínico

Resultados del estudio LIFE-BTK
Eficacia Superior, Beneficios Sostenidos hasta 2 Años2†
| Esprit™ BTK ofrece resultados clínicos superiores a largo plazo en comparación con la ATP, particularmente en términos de salvamento de la extremidad y permeabilidad primaria a los 2 años. Una clara ventaja sobre la ATP en términos de permeabilidad vascular sostenida y preservación de la extremidad2 | 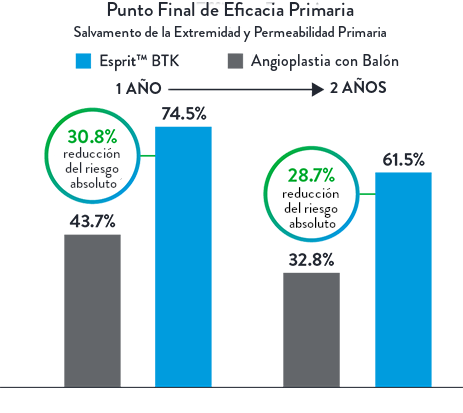 |
48% Menos Pacientes Requieren Reintervención a los 2 Años2*
| Esprit™ BTK reduce significativamente la reestenosis binaria y la oclusión total, debido a su eficacia biológica y soporte mecánico reabsorbible. Esprit™ BTK demuestra durabilidad a largo plazo, reduciendo eficazmente la reestenosis y promoviendo la permeabilidad vascular a largo plazo. | 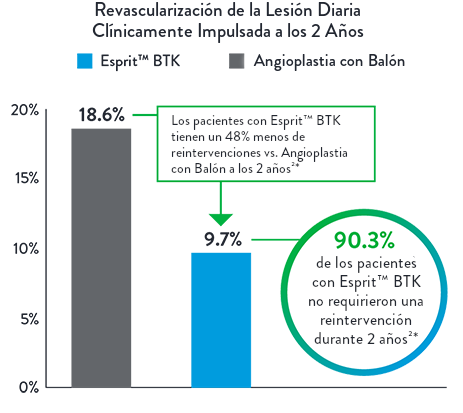 |
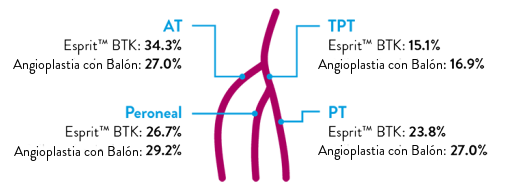
Tasa Constantemente Mayor Observada de Salvamento de la Extremidad y Permeabilidad Primaria Con Esprit™ BTK en un Rango de Longitud de Lesión de hasta 148 mm
Punto Final de Eficacia Primaria
Compuesto de Salvamento de la Extremidad y Permeabilidad Primaria al 1 Año
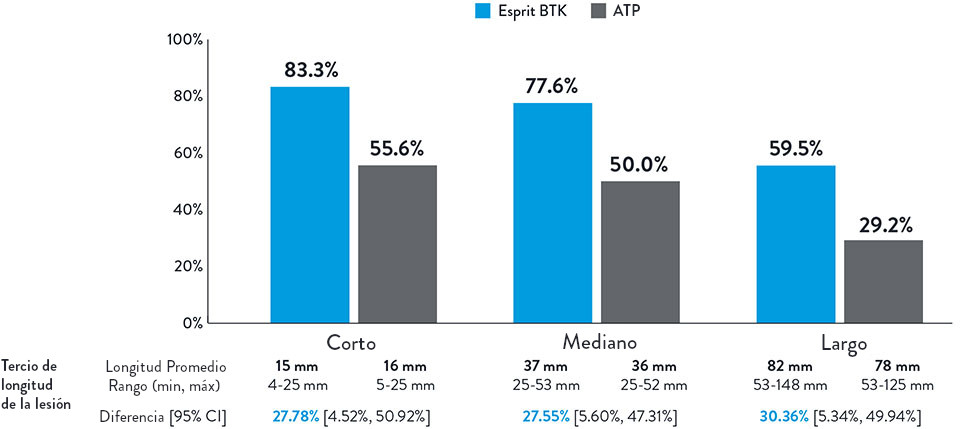
NOTA: Se realizó un análisis post-hoc (posterior) de subgrupos por terciles de longitud de la lesión donde no se completó la prueba de hipótesis preespecificada para proporcionar un valor p.
Varcoe, Ramon L., et. al. "Supplementary Appendix." In "Drug-eluting resorbable scaffold versus angioplasty for infrapopliteal artery disease." New England Journal of Medicine. 390 (2024): 9-19.
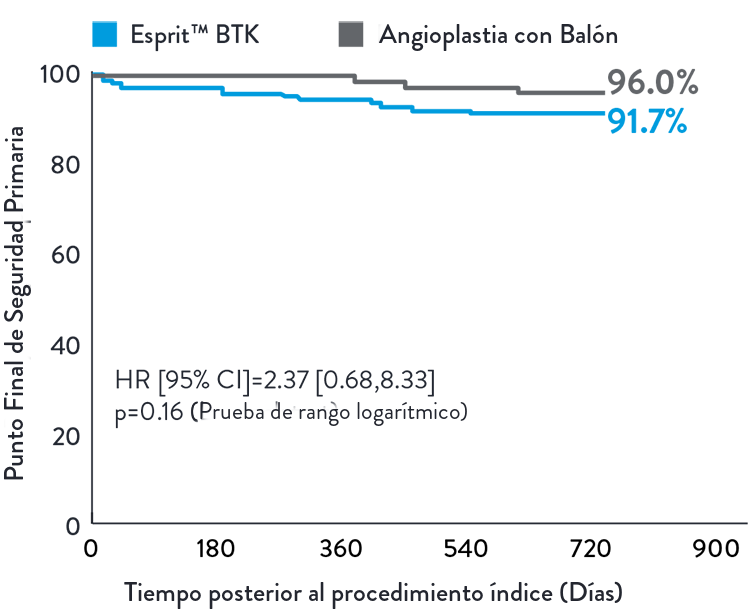
Se demostró que Esprit™ BTK es tan seguro como la angioplastia con balón, mantenido a los 2 años.2
Compuesto de MALE (2 años) y POD (30 días)
Diseño del estudio LIFE-BTK*
- Ensayo prospectivo, aleatorizado, multicéntrico en 50 sitios globales
- 261 pacientes aleatorizados (2:1 Sistema Esprit™ BTK vs. ATP†)
- Sistema Esprit™ BTK (n=173)
- ATP+ (n=88)
** El seguimiento se centró en la evaluación de la herida índice
† definido como Angioplastia Transluminal Percutánea
Sitios e Inscripción
Total Enrolled Sites: 50 | Total Randomized Patients: 261

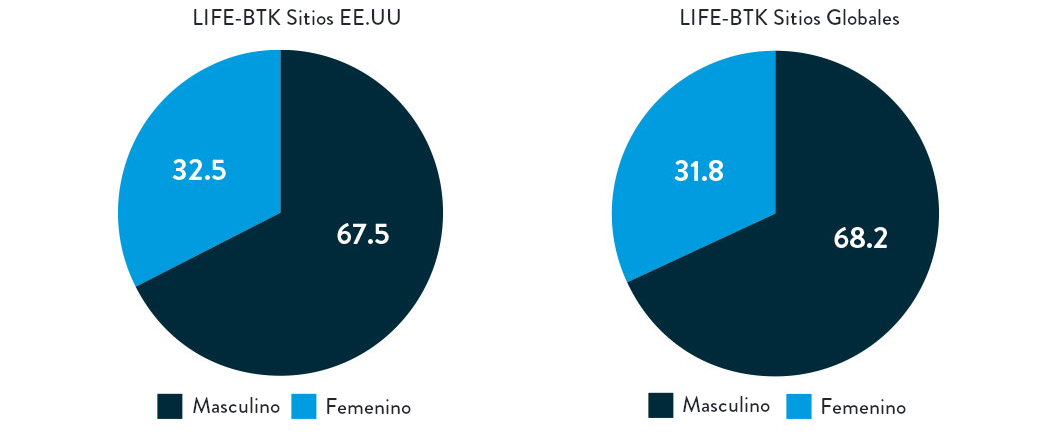
Distribución por Raza, Género y Etnia
El ensayo LIFE-BTK fue diseñado y llevado a cabo para incluir una población de pacientes diversa representativa de aquellos más afectados por la enfermedad5
Distribución por raza, género y etnia
Género
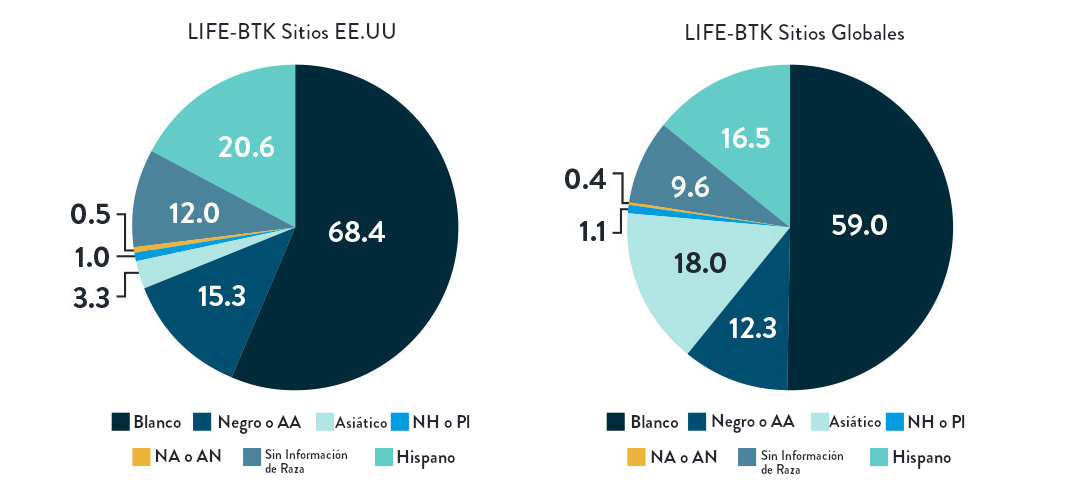
Raza y Etnia
AA: Afroamericano | NH: Nativo Hawaiano | PI: Isleño del Pacífico | NA: Nativo Americano/Indio Americano del Norte | AN: Nativo de Alaska
Varcoe, R. Primary Outcomes of the Esprit™ BTK Drug-Eluting Resorbable Scaffold for the Treatment of Infrapopliteal Lesions: The LIFE-BTK Trial. Presented at TCT 2023
Eficacia y Durabilidad Probadas en Diversas Razas y Etnias
Punto Final Primario Compuesto de Eficacia al 1 Año
Análisis de Subgrupos por Raza y Etnia

LIFE-BTK Puntos Finales al 1 Año
| PUNTO FINAL DE EFICACIA PRIMARIA | PPUNTO FINAL DE SEGURIDAD PRIMARIA | |
|---|---|---|
| Punto Final | Salvamento de la Extremidad + Permeabilidad Primaria | Libertad de MALE + POD |
| Definición | Libertad de amputación por encima del tobillo en la extremidad índice, oclusión total del 100% del vaso diana, reestenosis binaria de la lesión diana y CD-TLR* a los 12 meses | MALE = Amputación por encima del tobillo en la extremidad índice, reintervención mayor a los 6 meses POD = Mortalidad perioperatoria a los 30 días |
| Prueba | Superioridad de Esprit™ BTK contra ATP con una a de 1 lado de 0.0249 | No inferioridad de Esprit™ BTK contra ATP con una a de 1 lado de 0.025. |
| 1er PUNTO FINAL SECUNDARIO | 2do PUNTO FINAL SECUNDARIO | |
|---|---|---|
| Punto Final | Reestenosis binaria de la lesión diana al 1 año | Libertad de amputación por encima del tobillo en la extremidad índice, oclusión total del 100% del vaso diana y CD-TLR al 1 año |
| Prueba | Superioridad de Esprit™ BTK contra ATP con una a de 1 lado de 0.025 | Superioridad de Esprit™ BTK contra ATP con una a de 1 lado de 0.025 |
 |
Características Basales de Lesión y Paciente
|
|
Estructura reabsorbible compuesta de 100% poli (L-láctido) (PLLA) y espesor de puntal de 99 μm**
|
 |
Sistema de Administración
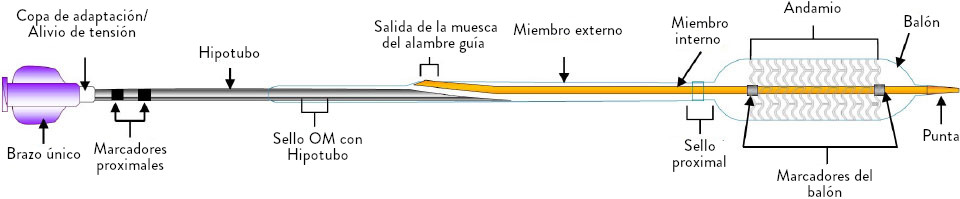
***Los marcadores de platino en los extremos proximal y distal permanecen para la visualización angiográfica
Datos en archivo en Abbott.
Fotos en archivo en Abbott.

Resultados del Estudio XIENCE 28 y XIENCE 906
Stent XIENCE™ con DAPT a corto plazo: Eventos isquémicos
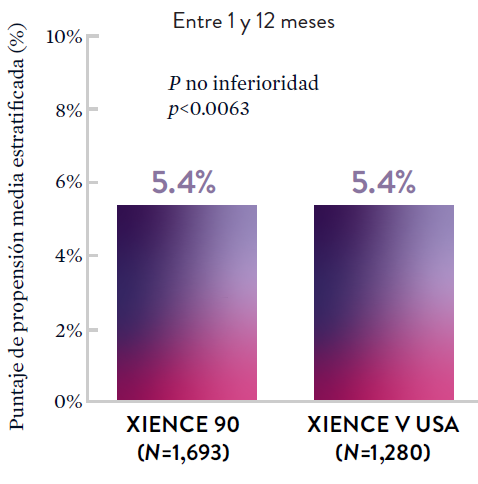
Entre los pacientes con alto riesgo de sangrado (HBR), el stent XIENCE™ con DAPT de 1 o 3 meses redujo el sangrado grave sin aumento en los eventos isquémicos, incluido el infarto de miocardio (IM) y todas las muertes.6
XIENCE 28: DAPT de 1 mes en pacientes con alto riesgo de sangrado (HBR)
XIENCE 28: Todas las muertes o IM
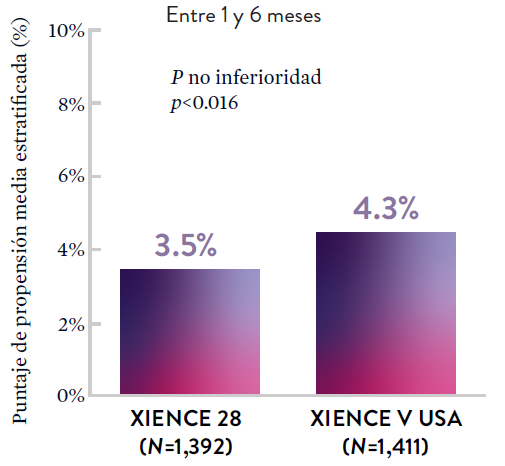
XIENCE 90: DAPT de 1 mes en Pacientes con alto riesgo de sangrado (HBR)
XIENCE 90: Todas las muertes o IM
Stent XIENCE™ con DAPT a corto plazo: Reducción del sangrado severo
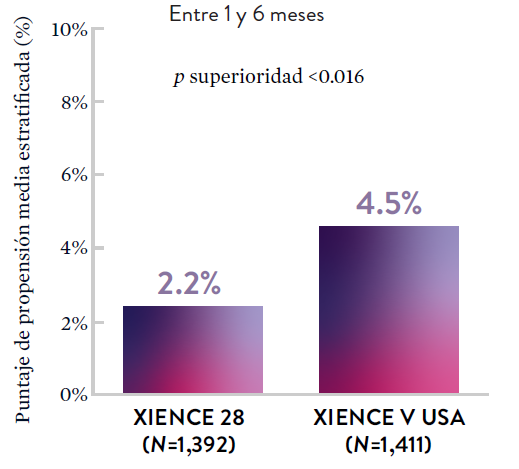
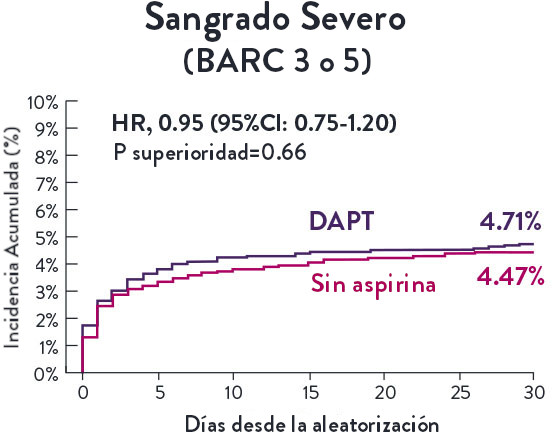
En la misma población de pacientes con alto riesgo de sangrado (HBR), el stent XIENCE™ con DAPT de 1 o 3 meses redujo el sangrado severo sin aumento en los eventos isquémicos.6,*
XIENCE 28: Sangrado BARC 3-5
XIENCE 90: Sangrado BARC 3-5
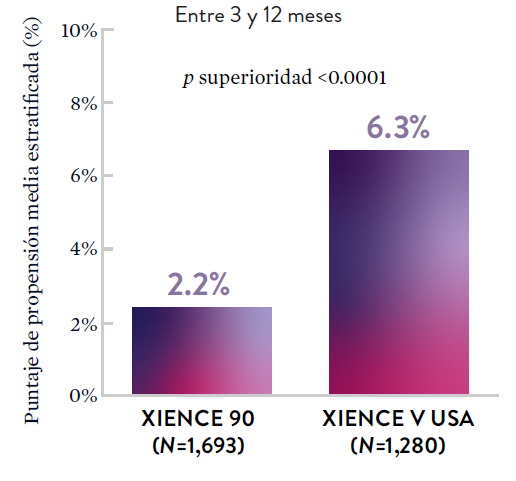
*El análisis estratificado por puntaje de propensión para el sangrado BARC 3-5 no fue preespecificado. BARC 2-5 fue un criterio de evaluación secundario reforzado para su significación estadística. En ambos estudios, para BARC 2-5, el stent XIENCE™ mostró una tasa de sangrado numéricamente menor para DAPT de 1 o 3 meses frente a una DAPT de 6 meses o DAPT de 12 meses, respectivamente.
Stent XIENCE™ con DAPT a corto plazo: Baja tasa continua de trombosis del stent
El stent XIENCE™ es reconocido por sus tasas bajas de trombosis del stent (ST), y es significativamente más tromborresistente que otros DES.7 Esto es evidente, incluso con datos de DAPT a corto plazo. El stent XIENCE™ con DAPT de 1 mes no mostró aumento en la ST frente a una DAPT de 6 meses, con una tasa de ST de 0.3%. De manera similar, el DAPT de 3 meses mostró una tasa de ST de 0.2%.6
XIENCE 28: Trombosis del stent (ST)
Entre 1 y 6 meses
ARC: ST Definitiva/Probable
El stent XIENCE™ con DAPT corto muestra tasas consistentemente bajas de trombosis del stent: DAPT de 1 y 6 meses son ambos de 0,3% ST, y DAPT de 3 y 12 meses son ambos de 0,2% ST.XIENCE 90: Trombosis del stent (ST)
Entre 3 y 12 meses
ARC: ST Definitiva/Probable
El stent XIENCE™ con DAPT corto muestra tasas consistentemente bajas de trombosis del stent: DAPT de 1 y 6 meses son ambos de 0,3% ST, y DAPT de 3 y 12 meses son ambos de 0,2% ST.El stent XIENCE™ es tromborresistente: Adecuado para la DAPT a corto plazo
El stent XIENCE™ también es reconocido por ser significativamente más tromborresistente que otros DES disponibles en el mercado. Como muestran los hallazgos del estudio, el stent XIENCE™ muestra significativamente menor adhesión plaquetaria (p<0.01) en comparación con otros DES — como se muestra en rojo en las imágenes de microscopía confocal. La adhesión plaquetaria es un factor importante en la trombosis del stent.*8 Estos hallazgos sugieren que esta elección de stent "puede ser idealmente adecuada para DAPT a muy corto plazo".8
*Modelo de desviación ex-vivo en cerdos.


Estudios STOPDAPT: DAPT de 1 mes y 3 meses en una población general9,10
STOPDAPT9 y STOPDAPT 210 fueron ensayos prospectivos del stent XIENCE™ que estudiaron la interrupción de la DAPT a los 3 meses y 1 mes, respectivamente.
Ensayo STOPDAPT 2: DAPT de 1 mes superior a la DAPT de 12 meses10
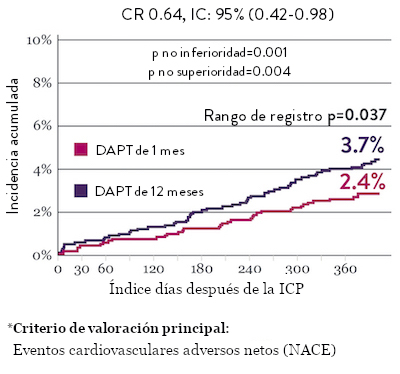
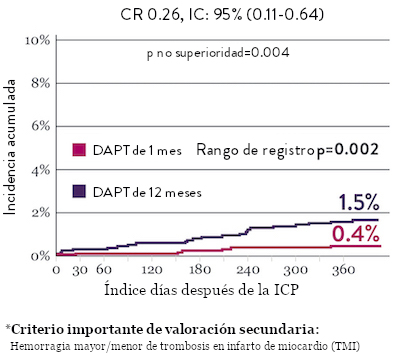
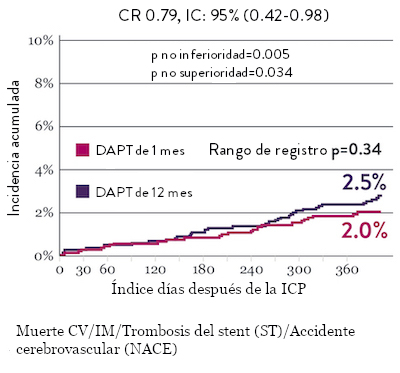
El ensayo STOPDAPT 2 reveló que la DAPT de 1 mes demostró seguridad superior a la DAPT de 12 meses, para el criterio de valoración principal de eventos cardiovasculares adversos netos (NACE, por sus siglas en inglés). El NACE incluyó muerte cardiovascular, infarto de miocardio (IM), trombosis del stent (ST) definitiva, accidente cerebrovascular o hemorragia mayor/menor de trombosis en infarto al miocardio (TIMI, por sus siglas en inglés). Los 3,009 pacientes de este ensayo controlado y aleatorizado fueron tratados con el stent XIENCE™.10
NACE* significativamente menor con DAPT de 1 mes
Sangrado significativamente menor* con DAPT de 1 Mes
Tasas de eventos isquémicos comparables* con DAPT de 1 mes

“Interrumpir la DAPT a los 3 meses en pacientes seleccionados después de la implantación [del stent XIENCE™] fue tan seguro como el régimen prolongado de DAPT adoptado en el grupo de control histórico.”
— Masahiro Natsuaki, MD, Ensayo STOPDAPT9

Diseño y aleatorización del Ensayo STOPDAPT 210

DAPT corto de 1 mes
- 0 a 1-mes: Aspirina + P2Y12
- Después de 1 mes: Monoterapia con clopidogrel

DAPT de 12 meses
- 0 a 1 mes: Aspirina + P2Y12
- 1 a 12 meses: Aspirina + Clopidogrel
- 12 a 60 meses: Monoterapia con aspirina

- Intervención coronaria percutánea (ICP) exitosa utilizando un stent liberador de everolimus de cobalto-cromo: XIENCE™
- Candidato para DAPT (aspirina/inhibidor del receptor P2Y12) durante 1 año

- Pacientes que necesitan anticoagulantes orales
- Historial de hemorragia intracraneal
- Complicaciones importantes en el hospital (IM/accidente cerebrovascular/hemorragia mayor)
Ensayo STOPDAPT: La combinación del stent XIENCE™ con DAPT de 3 meses es factible9
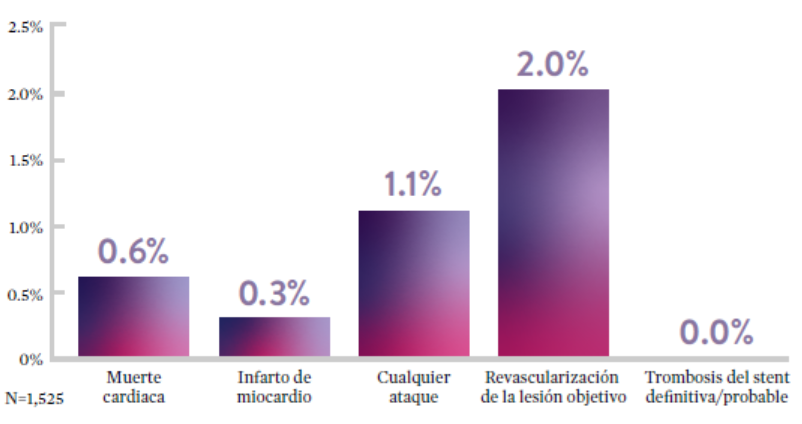
STOPDAPT9 fue el primer ensayo prospectivo que estudió la interrupción de la DAPT a los 3 meses después de la implantación. Entre otros resultados a 1 año, la tasa de trombosis de stent con XIENCE™ fue de 0.0%.
El ensayo STOPDAPT demuestra la factibilidad de usar el stent XIENCE™ con DAPT de 3 meses9

Conozca más acerca de STOPDAPT 2

“Vale la pena destacar que no se produjo ninguna trombosis de stent definitiva o probable en los pacientes tratados con XIENCE™ incluidos en STOPDAPT.”
— Masahiro Natsuaki, MD, Ensayo STOPDAPT9

STOPDAPT-3 Trial Design and Randomization11

- ICP con uso exclusivo y planificado de un stent liberador de everolimus (EES, por sus siglas en inglés ) de CoCr (XIENCE™)
- Presencia de paro cardíaco súbito (SCA, por sus siglas en inglés) o ARC-HBR
- Elegible para DAPT (aspirina/inhibidor P2Y12) durante 1 mes.
Diseño del estudio y aleatorización
Grupo 1:
0 a 1 mes: Aspirina + P2Y12 (Prasugrel)
Después de 1 mes: Monoterapia con clopidogrel
Grupo 2:
0 a 1 mes: P2Y12 (Prasugrel)
Después de 1 mes: Monoterapia con clopidogrel
El Ensayo STOPDAPT-311 se diseñó para estudiar la DAPT de 0 meses* (SAPT˄ utilizando solamente un inhibidor P2Y12) para pacientes con paro cardiaco súbito (SCA) y alto riesgo de sangrado (HBR).
Aunque los resultados son comparables tanto para hemorragias como para eventos isquémicos en los brazos de DAPT y TAPS, el estudio no cumplió con su criterio de valoración y concluyó en usar DAPT durante 1 mes después de la ICP.


El stent XIENCE™ sigue siendo el ÚNICO DES con la indicación de DAPT más corta, que puede ser tan corta como 28 días.12


Referencias
+Pruebas de superioridad realizadas al 1 año.
*Reintervención definida como CD-TLR.
- Varcoe, RL., et al. Drug-Eluting Resorbable Scaffold versus Angioplasty for Infrapopliteal Artery Disease. N Eng J Med 2024;390:9-19.
- Brian G. DeRubertis et al., Two-Year Outcomes of the LIFE-BTK Randomized Controlled Trial Evaluating the Esprit™ BTK Drug-eluting Resorbable Scaffold for Treatment of Infrapopliteal Lesions, VIVA 2024.
- Eid MA, et al. Semin Vasc Surg. 2021;34(1):38-46.
- Chen L, et al. Front Cardiovasc Med. 2021;8:692236.
- Garcia, LA, et al. Diversity, Equity, and Inclusion in the LIFE-BTK Trial Evaluating the Esprit™ BTK Drug-Eluting Resorbable Scaffold for the Treatment of Infrapopliteal Lesions in Patients with Chronic Limb-Threatening Ischemia, VIVA 2024.

MAT-XXXXXXX



